Post n. 25
Il problema è stato
spesso menzionato: se nell’esperimento di Miller e di altri ricercatori, e anche
nei meteoriti sono stati individuati circa 60 amminoacidi come mai solo 20 sono
entrati a far parte delle proteine? E poi: ma questi venti amminoacidi erano
veramente tutti presenti in epoca prebiotica? E se non erano tutti presenti, quanti
e quali furono gli amminoacidi costituenti delle prime proteine? E come sono
stati scelti?
I 20 amminoacidi in
questione sono:
Gly (Glicina), Ala
(Alanina), Val (Valina), Leu (Leucina), Ileu (Isoleucina), Pro (Prolina), Asp
(Acido aspartico), Glu (Acido glutammico), Ser (Serina), Thr (Treonina), Gln (Glutammina),
Asn (Asparagina), Met (Metionina), Cys (Cisteina), Phe (Fenilalanina), Tyr
(Tirosina), Trp (triptofano),
Hys (Istidina), Arg
(Arginina), Lys (Lisina).
La maggior parte
degli scienziati che si occupano dell’origine della vita è dell’opinione che il
numero di amminoacidi, quando ebbe inizio la vita, era sicuramente inferiore a
quello attuale. Pochi sono però i ricercatori che azzardano numeri e nomi. Tra
questi ultimi, chi ha affrontato in modo ampio il problema è stato Mario Ageno,
allievo di Enrico Fermi e padre della biofisica in Italia. Egli parte da un
lavoro di Miller del 1974 che riesamina i risultati di tutti gli
esperimenti condotti fino a quell’epoca e dimostra, al di là di ogni possibile dubbio, la sintesi prebiotica di 12
amminoacidi:
Gly, Ala, Val, Leu, Ileu, Pro, Asp, Glu, Ser, Thr, Gln, Asn
Miller
mette in evidenza come aggiungendo H2S (acido solfidrico)
all’atmosfera-modello primitiva (CH4, NH3, H2O,
H2) si ottiene facilmente la
Met
mentre la
Cys
è stata ottenuta da Khane e Sagan
sottoponendo a radiazione ultravioletta una miscela di: CH4, C2H6,
NH3, H2O, H2S.
Inoltre attraverso processi di pirolisi e
reazioni in soluzione si ottengono
Phe, Tyr,
Trp
Infine dalla sintesi della Pro e dell’acido pipecolico si ottengono
Arg, Lys
L’Istidina rimane l’unico amminoacido che non
è mai stato sintetizzato per via prebiotica.
Naturalmente non è escluso, anzi è molto
probabile, che i processi di sintesi degli amminoacidi in epoca prebiotica abbiano
seguito, in molti casi, vie diverse da quelle sopra esposte.
Poniamo l’attenzione per il momento sui 12
amminoacidi di sicura origine prebiotica e vediamo in seguito quali altri
processi di sintesi abiotica degli amminoacidi possiamo ritenere plausibile.
Ageno suggerisce di
partire da uno studio formale del codice genetico, cioè della legge di
corrispondenza tra l`RNA e gli amminoacidi.
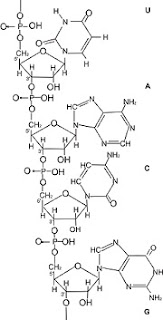
L’RNA è l’acido nucleico che trasporta
l’informazione per la sintesi delle proteine.
I costituenti degli dell’RNA sono:
il gruppo fosfato: (H2PO4)-.
Uno zucchero, il Ribosio
Quattro basi azotate: A (Adenina), G (Guanina), U (Uracile), C
(Citosina).
Un gruppo fosfato, una molecola di Ribosio, e una molecola
qualsiasi delle quattro basi danno origine a quattro diversi aggregati che
prendono il nome di nucleotidi. Come esempio si riporta l’Adenosin-5-fosfato.
Legando insieme mediamente 300 nucleotidi diversi si ottiene un
macromolecola: l’RNA
(Figure da: “Lezioni di biofisica)” di
Mario Ageno
Nell’RNA ai tre nucleotidi adiacenti si dà
il nome di “tripletta”. Per esempio, nella figura i tre nucleotidi UAC
costituiscono una tripletta. Se a seguire, nella figura, ci fossero GUA,
saremmo in presenza di un’altra tripletta e così via. A partire da questa
macromolecola di RNA, attraverso un processo, oggi abbastanza complesso,
vengono assemblate le proteine. Ad ogni tripletta corrisponde uno specifico
amminoacido, uno e uno solo, e tale legge di corrispondenza, rappresentata con
3:1, viene chiamata: codice genetico.
Tutti gli organismi viventi sul nostro pianeta utilizzano lo stesso codice
genetico, esso è quindi universale.
Avendo a disposizione quattro nucleotidi i
modi in cui li possiamo disporre tre a tre, cioè il totale delle triplette che
possiamo ottenere, sono 43 = 64. Tre di queste triplette sono utilizzate
come segnale di termine(t.), quindi, in teoria, l’RNA contiene l’informazione
per 61 amminoacidi. Poiché gli amminoacidi a disposizione di tutti gli organismi
viventi sono solo 20, il codice genetico è degenere
nel senso che più triplette codificano per lo stesso amminoacido.
Per esempio le triplette che presentano in 1a, 2a,
e 3a posizione GUU, GUC, GUA, GUG, codificano tutte lo stesso
amminoacido: la Valina (Val).
In riferimento alla legge di corrispondenza, Mario Ageno si chiede
se il codice genetico sia stato fin dalle origini 3:1; è possibile che in epoca
primitiva esso fosse diverso per esempio 2:1? Egli, in “Lezioni di Biofisica”
1984, esclude una simile eventualità, perché, in tal caso, tutti i processi
metabolici realizzati con un codice 2:1 sarebbero andati persi nel passaggio ad
un codice 3:1 e l’evoluzione avrebbe dovuto cominciare da capo, ma aggiunge: «È
tuttavia ammissibile che all’inizio non tutte le tre posizioni venissero lette:
forse le prime due mentre la terza aveva la funzione di spaziatura».
Egli però non approfondisce le conseguenze di una simile
eventualità sul numero e la scelta degli amminoacidi in epoca prebiotica,
conseguenze che affronteremo noi nel proseguo dell’articolo.
In relazione agli amminoacidi presenti in
epoca prebiotica, analizzando il codice genetico, Mario Ageno scrive: «la
stessa struttura formale del codice genetico suggerisce che i due amminoacidi
Metionina (Met) e Triptofano (Trp) siano di introduzione abbastanza recente».
Egli prende poi in considerazione gli studi
sulla sequenza amminoacidica delle proteine, in particolare emoglobine e
citocromo, contenute in specie diverse. Egli analizza un particolare tipo di
proteine considerate di origine arcaica: le Ferrodoxine. Come noto, uno dei
processi evolutivi che porta a nuove proteine è il raddoppio del gene. Tale
gene esprimerà una proteina di lunghezza doppia ma costituita da due sequenze
identiche di amminoacidi che con il tempo, per effetto delle mutazioni,
divergeranno. Però è spesso possibile risalire alla proteina originaria, ed è
ciò che è stato fatto con le Ferrodoxine. Si è potuto dimostrare che queste
proteine derivano tutte da una proteina originaria di 27 amminoacidi,
considerata una delle prime proteine comparse durante il processo che ha dato
origine alla vita.
Questa proteina arcaica risulta costituita da
nove amminoacidi diversi e cioè:
Gly, Ala,
Val, Glu, Asp, Pro, Cys, Ser, Ileu
Seguendo un ragionamento diverso, Jukes
aggiunge anche la Leu. Come si vede tutti, tranne la Cys, fanno parte dei 12
amminoacidi, di sicura origine prebiotica, del riesame di Miller. Ageno
suggerisce quindi, che il numero degli amminoacidi in epoca prebiotica potevano
essere circa la metà di quelli attuali.
Questa conclusione crea però dei problemi.
Se in epoca prebiotica fossero stati presente
solo 10 amminoacidi molte triplette sarebbero state non senso. Per esempio,
quattro triplette con C e G in 1a e 2a posizione e due triplette con A e G in 1a
e 2a posizione codificano
tutte Arg. Poiché Arg non figura tra i dieci sopra elencati, e neanche tra i 12
del riesame di Miller, queste triplette sarebbero state triplette non senso. Ma Ageno esclude categoricamente l’esistenza,
in epoca prebiotica, di triplette non
senso, perché mutazioni puntiformi avrebbero interrotto la sintesi proteica
con esiti letali. Per risolvere il problema, Egli introduce il fenomeno del
“tentennamento”. Immagina che la lettera centrale -U- indicasse un amminoacido
idrofobo (che non si lega con H2O) mentre –A- indicasse un
amminoacido idrofilo (che si lega con H2O), lasciando la precisa
specificazione dei risultati all’evoluzione.
Questa spiegazione crea però altri problemi. Perché l’Arg e la Ser pur essendo idrofile
non hanno A in seconda posizione ma C? E la Pro perché non ha U in seconda
posizione pur essendo un idrofobo? Eppure sia nel primo che nel secondo caso ci
sarebbero triplette a disposizione perché, come si vede, più triplette
codificano lo stesso amminoacido, per esempio la Pro avrebbe potuto sostituire
una tripletta delle Leu.
Bisogna inoltre aggiungere che la comparsa di
un nuovo amminoacido comporta anche l’apertura di una nuova via metabolica. È
abbastanza difficile immaginare che la vita appena formata e in fase di
evoluzione, venga sottoposta allo stress di creare continuamente un numero così
elevato di nuove vie metaboliche. In definitiva la presenza, in epoca
prebiotica, dei dieci amminoacidi sopra elencati è credibile, però poiché non
potevano esistere triplette non senso non può essere il numero definitivo. Possiamo
concludere che il problema di quanti fossero gli amminoacidi in epoca
prebiotica, quali fossero e come siano stati scelti rimane fin qui irrisolto.
Riprendiamo
allora il lavoro di Miller. Come si vede, sia tra i 12 amminoacidi del riesame
che tra i componenti della proteina arcaica è presente la Pro. Ma come
suggerisce Ageno la sintesi della Pro implica la sintesi di Arg e Lys. L’Arg,
inoltre, non poteva mancare altrimenti avremmo avuto 6 triplette non senso. Sembra
quindi abbastanza ragionevole aggiungere, all’elenco dei 12 anche questi due
amminoacidi.
Prendiamo
adesso in considerazione la sintesi di Met e Cys.
Come abbiamo
visto nel riesame di Miller, aggiungendo H2S (acido solfidrico)
all’atmosfera-modello primitiva (CH4, NH3, H2O,
H2) si ottiene la Met, mentre la Cys è stata ottenuta da Khane e
Sagan sottoponendo a radiazione ultravioletta una miscela di: CH4, C2H6,
NH3, H2O, H2S. Ora, a prima vista sembra
 |
| fotoalbum.virgilio.it |
chimicamente più semplice la formazione di Met che di Cys. Eppure la Cys è uno
dei nove amminoacidi componenti le ferrodoxine, proteine arcaiche comparse
durante il processo che ha dato origine alla vita. Ma se si è formata la Cys sicuramente si è
formata anche la Met. Noi in realtà non abbiamo nessun elemento valido che ci
possa fare escludere la Met. Anche questi 2 amminoacidi andrebbero quindi aggiunti
ai dodici già elencati. Però, poiché nessun ricercatore ha mai ipotizzato che
l’atmosfera terrestre contenesse H2S a livello planetario, dobbiamo ritenere
che questi due amminoacidi si siano formati soltanto in luoghi dove H2S
era presente, cioè in prossimità di zone vulcaniche.
Secondo
Christian de Duve in “Alle origini della vita” 2010, Triptofano(Trp) e Istidina(Hys)
sono apparsi più tardi nello sviluppo della vita. Essi, infatti, non sono stati
trovati nei meteoriti ed inoltre l’Istidina non è mai stata sintetizzata in
esperimenti di chimica prebiotica.
Richiamando ancora il riesame di Miller, Phe
(Fenilalanina), Tyr (Tirosina),
Trp (Triptofano) sono stati ottenuti attraverso
processi di pirolisi e reazioni in soluzione. I processi di pirolisi, cioè
demolizioni di composti tramite il calore, sono processi che avvengono ad alta
temperatura. In laboratorio e nell’industria danno buone rese perché sono
processi ben controllati. Questi tre amminoacidi hanno una struttura molecolare
abbastanza complessa, e il Trp è il più complesso dei tre. Ma de Duve non
 |
| www.sunovnik.net |
Concludendo, l’analisi fin qui condotta ci
suggerisce due conclusione:
A) Gli amminoacidi presenti in epoca
prebiotica erano 14 e cioè:
Gly, Ala, Val, Leu, Ileu, Pro, Asp, Glu, Ser, Thr, Gln, Asn, Arg, Lys
gli altri 6 erano
assenti.
B) I 20 amminoacidi
attuali era tutti presenti ma un primo gruppo, diffuso su tutta la superfice
del pianeta, costituito dai 14 amminoacidi sopra elencati e cioè:
Gly, Ala, Val, Leu, Ileu, Pro, Asp, Glu, Ser, Thr, Gln, Asn, Arg, Lys
Un secondo gruppo
localizzato, cioè che si è formato in particolari zone della del pianeta
probabilmente in prossimità di aree vulcaniche, costituito da 6 amminoacidi.
Met, Cys, Phe, Tyr, Trp, Hys
Seguiamo adesso un argomentazione diversa.
Come abbiamo già detto, Ageno non
approfondisce le conseguenze del fatto che, ad essere lette, fossero la coppia
di lettere in 1a e 2a posizione.
E allora, ripartiamo dalla struttura del
codice genetico e in particolare da una condizione necessaria: non possono
esistere triplette non senso. Questa
condizione può essere soddisfatta se la 1a e la 2a
posizione codificano almeno un amminoacido utilizzando la terza come
spaziatura. Questa possibilità è già stata ammessa da Ageno quando scrive: «È
tuttavia ammissibile che all’inizio non tutte le tre posizioni venissero lette:
forse le prime due mentre la terza aveva la funzione di spaziatura». Ora, se la
terza posizione si riduce a spaziatura il numero di amminoacidi che il codice
genetico può codificare utilizzando solo la 1a e la 2a
posizione si riduce a 24= 16. Questo significa che in epoca
prebiotica avremmo dovuto avere 16 amminoacidi, altrimenti saremmo stati in
presenza di triplette non senso.
Dal codice genetico si evince però, che Ser e
Arg oltre ad occupare le triplette con in 1a e 2a
posizione rispettivamente CC e CG occupano anche le triplette con AG in1a
e 2a posizione. Insomma 2 amminoacidi occupano 3 posizioni e quindi,
per non avere triplette non senso, erano sufficienti già 15 amminoacidi.
Inoltre, anche la Leu viene codificata da
triplette con in1a e 2a posizione CU e UU. La Leu occupa
da sola 2 posizioni e gli amminoacidi necessari scendono a 14.
In conclusione, per non avere triplette non
senso, erano necessari 14 amminoacidi. Mancano all’appello 6 amminoacidi.
Intanto è singolare il fatto che questi
numeri coincidono esattamente con le conclusioni sul riesame di Miller
riportate in A) e B).
Seguiamo ancora la struttura del codice
genetico e cerchiamo di individuare gli eventuali 6 amminoacidi mancanti.
Come si vede dal codice genetico esistono
coppie di amminoacidi che vengono codificate dalle stesse coppie di
nucleotidi in 1a e 2a posizione, essi sono:
UU- (Phe, Leu), AU- (Ileu, Met), CA-
(His, Gln), AA-(Asn,
Lys), GA-
(Asp, Glu), UG- (Cys, Trp), AG-
(Ser, Arg)
Inoltre UA-
(Tyr, t), dove t segnale di termine.
Per non
avere triplette non senso, in epoca prebiotica, almeno uno di questi
amminoacidi doveva essere presente.
Intanto Asp
e Glu erano sicuramente presenti perché sono stati individuate sia nelle
proteine arcaiche che tra gli amminoacidi di sicura origine prebiotica di
Miller.
Anche Ser e
Arg dovevano essere presenti altrimenti, come abbiamo poc’anzi, avremmo
triplette non senso.
Infine
dovevano essere presenti Leu, Ileu, Gln, Asn, e Cys perché già individuate o
tra gli amminoacidi di sicura origine prebiotica o nelle proteine di origine
arcaica.
I 6 amminoacidi
mancanti sarebbero allora:
Met, Phe, Tyr, Trp,
His, Lys.
Con Lys al
posto di Cys questi amminoacidi corrispondono esattamente al gruppo di 6 amminoacidi
che, come abbiamo supposto in B), probabilmente si sono formate in zone
vulcaniche. È importante qui sottolineare come, seguendo due percorsi
completamente diversi, a meno di un amminoacido, abbiamo ottenuto gli stessi
risultati sia in quantità che qualità.
Ma poi
questi 6 amminoacidi erano veramente mancanti?
Per Met,
Phe, Tyr, Trp vale lo stesso discorso che ci ha portato alle conclusioni A) e
B).
Arg (Arginina) e Lys (Lisina)
sono due molecole con catena laterale basica, ma la molecole della Lys è più
semplice della molecola dell’Arg. Non sembra quindi logico escludere la Lys.
Vogliamo
escludere l’His solo perché non è stata ancora individuata in esperimenti di
chimica prebiotica?
Ma allora
quanti e quali erano gli amminoacidi in epoca prebiotica?
Partiamo da
alcune considerazioni di Ageno:
Egli parte
dalla constatazione che l’introduzione di un nuovo amminoacido non è il
risultato di una semplice mutazione ma necessita l’impostazione di una nuova
via metabolica.
Inoltre se
l’introduzione di nuovi amminoacidi fosse facile, come mai il codice genetico è
universale? E come mai le diverse specie non hanno sviluppato un proprio codice
particolare? Ageno ammette che a queste domande non sappiamo rispondere.
In realtà a
queste domande una risposta si può dare, ed è la conclusione già esposta in B):
Gli attuali 20
amminoacidi erano tutti presenti ma vanno divisi in due gruppi.
Un primo gruppo,
diffuso su tutta la superfice del pianeta, era costituito dagli amminoacidi considerati
da Miller di sicura provenienza abiotica a cui aggiungere Arg e Lys, in totale
14 cioè:
Gly, Ala, Val, Leu, Ileu, Pro, Asp, Glu, Ser, Thr, Gln, Asn, Arg, Lys
Un secondo gruppo
localizzato, cioè che si è formato in particolari zone del pianeta probabilmente
in prossimità di aree vulcaniche, costituito da 6 amminoacidi.
Met, Cys, Phe, Tyr, Trp, Hys
Questa è, in definitiva, una conclusione quasi obbligata. Se il codice
genetico è universale, ne consegue che esso ha avuto origine quando ha avuto origine
la vita e quindi i 20 amminoacidi dovevano essere tutti presenti. Per la vita
in formazione, impostare ogni volta nuove vie metaboliche alla comparsa di
nuovi amminoacidi e quindi cambiare continuamente il codice genetico, sarebbe
stata letale.
Infine,
perché proprio questi 20 amminoacidi e non altri?
Della questione si sono occupati Arthur Weber e Stanley Miller in
“Reasons of the Occurrence of the Twenty Coded Protein Amino Acids” nel 1981. Essi riportano i lavori di diversi ricercatori, per noi di nessun
interesse, perché partono dall’assunto che la vita ha avuto origine in un brodo
prebiotico. Inoltre, i due scienziati sostengono improbabile che un singolo
processo possa spiegare la selezione dei venti amminoacidi.
Qui si sostiene invece che il brodo prebiotico non è mai esistito e che la vita ha avuto origine sulla terraferma.
Sosteniamo inoltre che l’esperimento sui doppi strati elettrici è a
tutt’oggi l’unico esperimento noto, di un singolo processo, dove un agente
fisico, il quarzo, collega deduttivamente la separazione, in epoca prebiotica,
degli amminoacidi Destro dai Levo coi principi fondamentali della teoria
fisica. Ipotizziamo inoltre, come abbiamo visto negli articoli, “Origine delle
proteine: il problema dell’asimmetria molecolare”, che la silice colloidale
abbia lo stesso comportamento del quarzo. Poiché ogni amminoacido possiede un
campo elettromagnetico associato alla propria molecola, dei circa 60
amminoacidi presenti in epoca prebiotica i 20 scelti solo quelli il cui campo
elettromagnetico era compatibile con i potenziali elettrocinetici della silice
colloidale.
Giovanni
Occhipinti
Prossimo articolo: Origine delle Proteine: 3) La formazione delle proteine (fine marzo)